UBICACIÓN DE LOS ELEMENTOS POR SU CONFIGURACIÓN ELECTRÓNICA
Configuración electrónica
El criterio principal de ordenación de los elementos dentro de la tabla periódica actual es el de número atómico creciente, pero también puedes observar que entre determinados elementos se producen "saltos" en su ubicación, como entre el hidrógeno (H) y el helio (He) o entre el berilio (Be) y el boro (B). Esto se debe a que los elementos con propiedades químicas similares se agrupan en la misma columna.
En la tabla periódica los elementos están colocados secuencial mente, esto es, por orden creciente de su número atómico. Además, elementos con comportamiento químico similar se sitúan en la misma columna.
Las filas y columnas de la tabla periódica de los elementos reciben un nombre específico con el que nos referiremos siempre a ellos:
- Grupos: son las columnas verticales de la tabla. Reciben este nombre por agrupar elementos de propiedades químicas similares.
- Periodos: son las filas horizontales de la tabla. Dentro de un periodo, los elementos están ordenados por número atómico creciente.
Dentro de un mismo grupo todos los elementos tienen la misma configuración electrónica en su última capa (conocida como capa de valencia).
Dentro de un mismo periodo los elementos se ordenan según su número atómico creciente y el último electrón está situado en la misma capa, correspondiente al número de periodo.
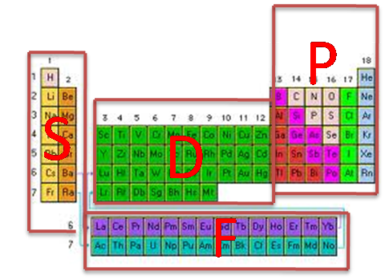
Clasificación de los elementos en la tabla periódica por bloques
Considerando el ultimo subnivel en la distribución electrónica de los elementos, éstos se clasifican en cuatro bloques (s, p, d, f) lo que permite identificar al grupo al cual pertenece cada elemento. El elemento cuya configuración electrónica termina en subnivel “s” o “p” es representativo (grupo A), si la configuración electrónica termina en subnivel “d” es un elemento de transición (grupo B), y si la configuración electrónica termina en “f”, es un elemento de transición interna o tierra rara (grupo IIIB).
La clasificación por bloques permite ubicar un elemento en la tabla periódica, es decir indicar el numero de periodo y el numero de grupo.
Ubicación de un Elemento en la Tabla Periódica:
Cada elemento pertenece a un casillero de la tabla periodica y puede ubicarse conociendo su numero atomico (Z) de acuerdo a los siguientes pasos:
1er paso: Tener presente que en un átomo neutro, Z es igual al numero de electrones.
2do paso: Realizar la distribución electrónica y analizar:
Periodo = está dado por el nivel externo o de mayor nivel (lo que determina el número de niveles del átomo)
Grupo = Si el último subnivel es “s” o “p”, entonces es del grupo A; si el último subnivel es “d", entonces es del grupo B; y si termina en subnivel “f”, es un elemento de transición interna o tierra rara (grupo IIIB).
Para elementos del grupo VIIIB, IB y IIB se debe considerar una regla práctica adicional:

Los elementos de transición interna pertenecen al grupo IIIB, entonces el periodo solo depende del último nivel (nivel mas externo), que puede ser 6 ó 7, es decir lantánidos o actínidos respectivamente.
Comentarios
Publicar un comentario